Istraživanja u laboratoriju usmjerena su na terapiju tumora te se mogu podijeliti u nekoliko međusobno prožetih cjelina:
1. Eksperimentalna terapija – interdisciplinarni pristup istraživanju antitumorskog učinka novosintetiziranih spojeva, kao i drugih prirodnih i komercijalnih potencijalnih protutumorskih lijekova
2. Molekularna onkologija – a) istraživanje uloge transporta iona, poglavito kalija, u liječenju tumora i osjetljivosti stanica tumora na terapiju te u invazivnosti; b) istraživanje uloge adhezije i modulacije esktracelularnog matriksa na invazivnost i liječenje tumora.
Ad 1. Eksperimentalna terapija
Istražujemo učinak i/ili mehanizam novosintetiziranih spojeva i drugih prirodnih i komercijalnih spojeva s potencijalnom protutumorskom aktivnošću. U suradnji s velikim brojem grupa iz područja organske kemije iz RH i inozemstva provodimo studije pretraživanja novosintetiziranih spojeva, kao i istraživanja mehanizama djelovanja najaktivnijih spojeva. U poslijednje vrijeme istraživanja su bila usmjerena na mogućnost modulacije ABC transportera, kao način povećanja osjetljivosti posebno rezistentnih tumora na terapiju.
Ovaj izrazito interdisciplinarni pristup istraživanju rezultirao je jedinstvenom ekspertizom u medicinskoj/farmaceutskoj kemiji i publikacijama u respektabilnim časopisima iz područja medicinske kemije, patentima te otkrićem nekoliko predvodnih molekula.
Izdvojeni radovi i patenti:
a) Hranjec, M; Kralj, M*; Piantanida, I; Sedić, M; Šuman, L; Pavelić, K; Karminski-Zamola, G*. Novel cyano- and amidino-substituted derivatives of styryl-2-benzimidazoles and benzimidazo[1, 2-a]quinolines. Synthesis, photochemical synthesis, DNA binding, and antitumor evaluation, part 3. J Med Chem. 50 (2007) , 23; 5696,
b) M. Marjanović, M. Kralj*, F. Supek, L. Frkanec, I. Piantanida, T. Šmuc, Lj. Tušek-Božić. Antitumor potential of crown ethers: structure activity relationships, cell cycle disturbances and cell death studies of a series of ionophores. J Med Chem (2007) 50:1007-1018
c) Supek, F; Šumanovac Ramljak, T; Marjanović, M; Buljubašić, M; Kragol, G; Ilić, N; Šmuc, T; Zahradka, D; Mlinarić-Majerski, K*; Kralj, M*. Could LogP be a principal determinant of biological activity in 18-crown-6 ethers? Synthesis of biologically active adamantane-substituted diaza-crowns. Eur J Med Chem. 46 (2011) 3444-3454
d) Kralj, M*; Tušek-Božić, Lj; Frkanec, L. Biomedical Potentials of Crown Ethers: Prospective Antitumor Agents. ChemMedChem. (2008) 3:1478-1492
e) Ester, K; Hranjec, M; Piantanida, I; Ćaleta, I; Ivana, J; Pavelić, K; Kralj, M*; Karminski-Zamola, G*. Novel Derivatives of Pyridyl-Benzo[b]thiophene-2-carboxamides and Benzo[b]thieno[2, 3- c]naphthyridin-2-ones: Minor Structural Variations Provoke Major Differences of Antitumor Action Mechanisms. J Med Chem. 52:2482-2492 (2009).
f) Supek, F#; Kralj, M#; Marjanović, M; Šuman, L; Šmuc, T; Krizmanić, I; Žinić, B. Atypical cytostatic mechanism of N -1-sulfonylcytosine derivatives determined by in vitro screening and computational analysis. Invest New drugs. (2008) 26:97-110., #First autor – equal conribution
g) Perin, N; Martin Kleiner, I; Nhili, R; Laine, W; David-Cordonnier, M-H; Vugrek, O; Karminski-Zamola, G; Kralj, M*; Hranjec, M*. Biological activity and DNA binding studies of 2-substituted benzimidazo[1, 2-a]quinolines bearing different amino side chains. MedChemComm. 4 (2013) 1537-1550.
h) Basarić, N; Mlinarić-Majerski, K; Kralj, M. Quinone methides: photochemical generation and its application in biomedicine. Current Organic Chemistry. (2014) 18; 3-18.
i) Kralj, M*; Uzelac, L; Wang, Yu-H; Wan, P; Tireli, M; Mlinarić-Majerski, K; Piantanida, I; Basarić, N*. Enhancement of antiproliferative activity by phototautomerization of anthrylphenols. Photochem. Photobiol. Sci. (2015) 14:1082-1092.
j) Levatić, J; Ćurak, J; Kralj, M; Šmuc, T; Osmak, M; Supek, F. Accurate Models for P-gp Drug Recognition Induced from a Cancer Cell Line Cytotoxicity Screen. J Med Chem. 56 (2013) 5691-5708.
k) Patent No. US 8,389,505 B2 (2013): Marijeta Kralj, Kata Majerski, Marko Marjanović i Tatjana Šumanovac Ramljak „Adamantane derivatives of aza-crown ethers and their use in treatment of tumor“
l) Guberović I#, Marjanović M#, Mioč M, Ester K, Martin-Kleiner I, Šumanovac Ramljak T, Mlinarić-Majerski K, Kralj M. Crown ethers reverse P-glycoprotein-mediated multidrug resistance in cancer cells. Sci Rep, 14467 (2018). #First autor – equal conribution
m) Patent No. US11103519B2 / EP3612538B1 (2017): Basarić, Nikola; Kralj, Marijeta; Mikecin, Ana-Matea; Cindrić, Matej: Quinone-methide precursors with bodipy chromophore, method of preparation, biological activity and application in fluorescent labeling.
n) Zlatić K, Antol I*, Uzelac L, Mikecin Dražić A-M, Kralj M*, Bohne C, Basarić N*. Labeling of Proteins by BODIPY-Quinone Methides Utilizing Anti-Kasha Photochemistry. ACS Appl. Mater. Interfaces (2020), 12, 347−351
o) Mioč M, Telbisz Á, Radman K, Bertoša B, Šumanovac T, Sarkadi B, Kralj M*. Interaction of crown ethers with the ABCG2 transporter and their implication for multidrug resistance reversal. Histochem Cell Biol. (2022) 158 (2022) str. 261-277.
p) Zlatić, K; Popović, M; Uzelac, L ; Kralj, M*; Basarić, N*. Antiproliferative activity of meso-substituted BODIPY photocages: Effect of electrophiles vs singlet oxygen. Eur J Med Chem, (2023) 259 ; 1-15
q) Mioč M, Beus M, Carević K, Rajić Z, Sarkadi B, Telbisz Á*, Kralj M*. Selective Inhibition of the ABCG2 Transporter by Primaquine Derivatives Reverses the Multidrug Resistance of Tumor Cells. Int J Mol Sci. (2025) 26:5367.
Ad 2. Molekularna onkologija
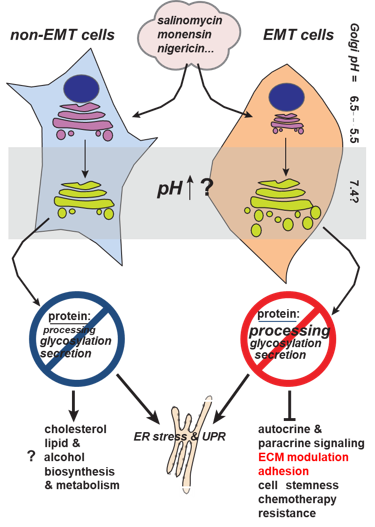
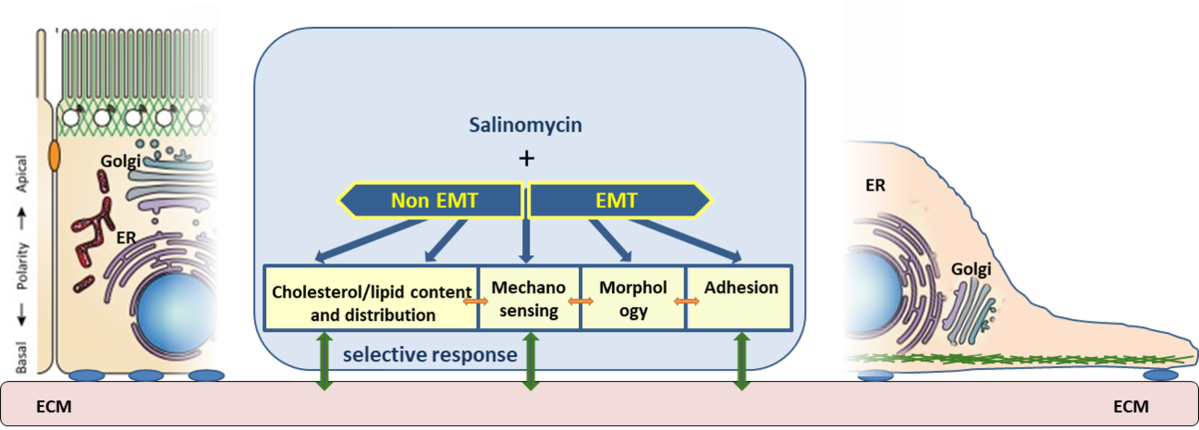
Naša su istraživanja usmjerena na potencijalnu protutumorsku aktivnost kalijevih ionofora. Posebno smo fokusirani na ispitivanja biološke aktivnosti krunastih etera, koji također imaju sposobnost transporta kalija kroz membrane te prirodne ionofore kao što su salinomicin, monenzin, nigericin. Primjerice, kalijev ionofor salinomicin je prepoznat kao potencijalno selektivan spoj za uništavanje tumorskih matičnih stanica (TMS). TMS, uz ostale karakteristike, pokazuju izrazitu rezistenciju na sve oblike terapije. Stoga je naše istraživanje bilo usmjereno na otkriće novih potencijalno selektivnih spojeva za TMS, kao i proučavanje svojstava TMS.
U radu koristimo model stanica koje su prošle tzv. epitelno-mezenhimalnu tranziciju (EMT) te imaju mnoge karakteristike TMS. U tom smislu istražujemo razlike između EMT stanica u odnosu na epitelne (non-EMT) stanice. Posebno smo se fokusirali na rasvjetljavanje diferencijalnih učinaka salinomicina na različite organele u ovom, ali i drugim staničnim modelima (Znanstveno-istraživački projekt “A multidisciplinary approach to discover selective drugs targeting cancer stem cells: The role of potassium transport - MultiCaST“ Hrvatska zaklada za znanost (HrZZ).
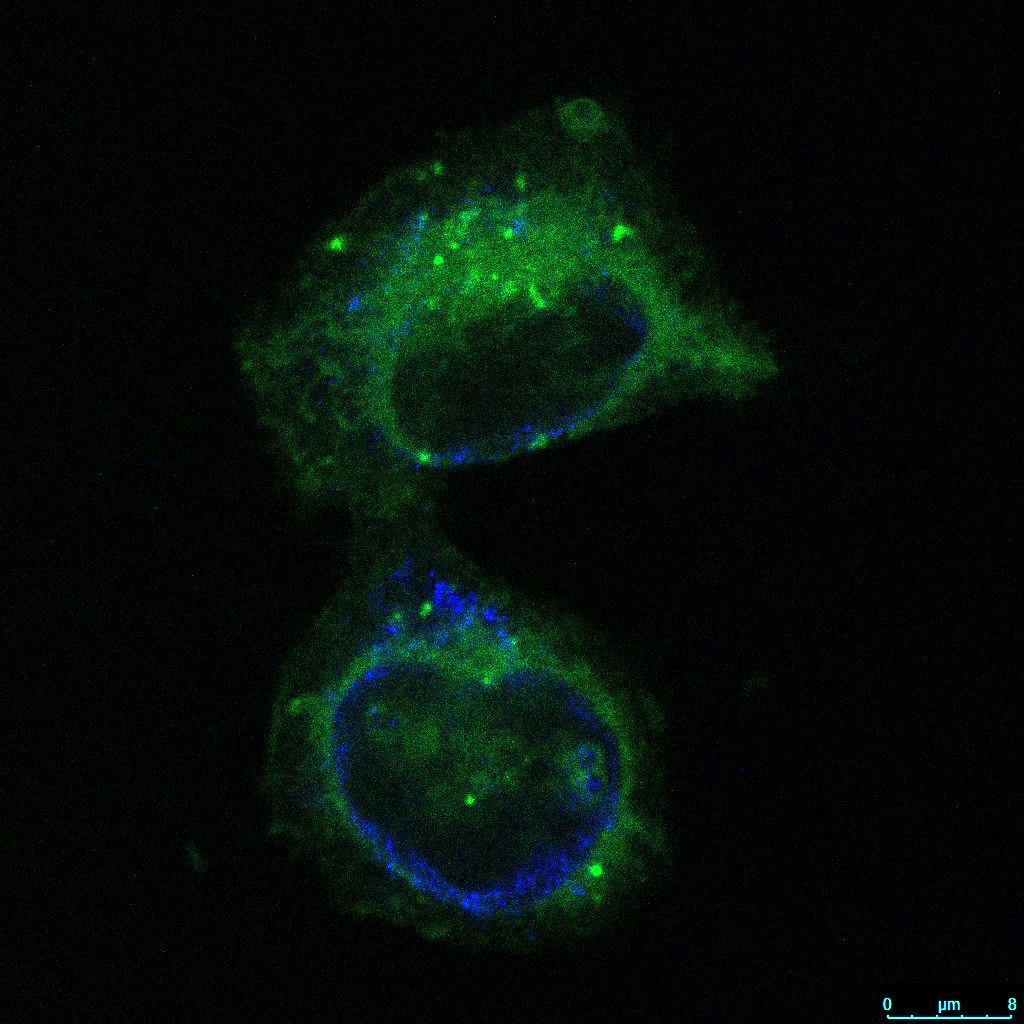
U našem smo istraživanju prvi dokazali da salinomicin utječe na funkciju i morfologiju Golgijevog aparata, pri ćemu su učinci bili značajniji u stanicama koje su prošle EMT.
Daljna istraživanja temeljena na analizi globalne ekspresije gena, pokazala je kako je process adhezije najzahvaćeniji biološki proces u EMT stanicama nakon tretmana sa salinomicinom, što nije slučaj u non-EMT stanicama. Ove diferencijalne mehanizme trenutno istražujemo.
Izdvojeni radovi:
- Marjanović M#, Mikecin Dražić A-M#, Mioč M, Paradžik M, Kliček F, Novokmet M, Lauc G, Kralj M*. Salinomycin disturbs Golgi apparatus function and specifically affects cells in epithelial-to-mesenchymal transition. Journal of Cell Science. (2023)136(17):jcs260934.
- Ester, K. et al. Targeting plasma membrane and mitochondrial instability in breast cancer cells and breast epithelial to mesenchymal transition-model cells by adamantyl diaza-crown ether ZG613. bioRxiv 2022.09.30.510273 (2022) doi:10.1101/2022.09.30.510273.
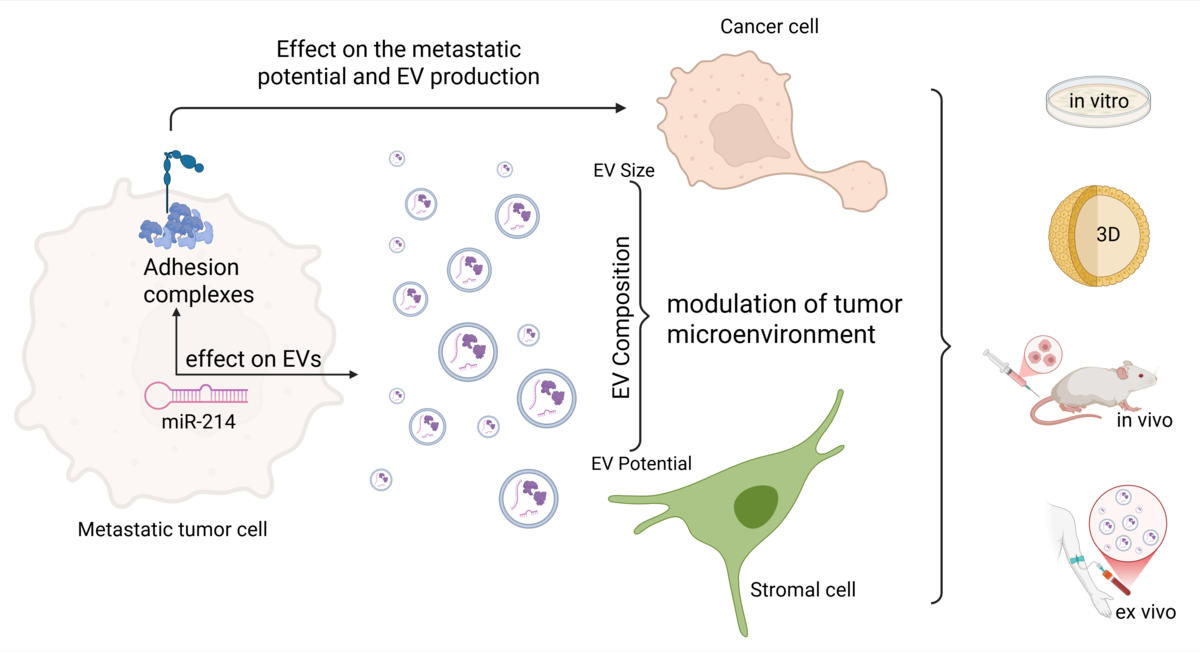
Istraživanja adhezije i adhezijskih kompleksa dodatno se provode na modelu trostrukonegativnog raka dojke. Pri tome se posebno proučava uloga malih nekodirajućih molekula RNA (miR) na adhezijske komplekse, kao i uloga miR u povećanju metastatskog potencijala, utjecaja na stvaranje ekstracelularnih vezikula kao načina međustanične komunikacije te općenito utjecaja na komunikaciju između tumorskih stanica te stanica mikrookoliša.
Izdvojeni radovi:
- Orso F, Virga F, Dettori D, Dalmasso A, Paradzik M, Savino A, Pomatto M.A.C., Quirico L, Cucinelli S, Coco M, Mareschi K, Fagioli F, Salmena L, Camussi G, Provero P, Poli V, Mazzone M, Pandolfi P P. & Taverna D. Stroma-derived miR-214 coordinates tumor dissemination J Exp Clin Cancer Res 2023 Jan 13;42(1):20. doi: 10.1186/s13046-022-02553-5
- Quirico L, Orso F, Cucinelli S, Paradžik M, Natalini D, Centonze G, Dalmasso A, La Vecchia S, Coco M, Audrito V, Riganti C, Defillipi P, Taverna D miRNA-guided reprogramming of glucose and glutamine metabolism and its impact on cell adhesion/migration during solid tumor progression; Cell Mol Life Sci. 2022 Mar 29;79(4):216. doi: 10.1007/s00018-022-04228-y.
Također, izučavanje adhezijskih kompleksa dovelo je i do interdisciplinarnog (evolucija, stanična biologija, bioinformatika) istraživanja u kojem smo se bavili podrijetlom interakcija među komponentama citoskeleta (aktinske niti, mikrotoubuli, intermedijalni filamenti), istražujući evolucijsku konzerviranost interakcija i definirajući pritom ključne proteine in silico.
Izdvojeni radovi:
- Paradžik T, Podgorski I I, Vojvoda Zeljko T, Paradžik M*. Ancient Origins of Cytoskeletal Crosstalk: Spectraplakin-like Proteins Precede the Emergence of Cortical Microtubule Stabilization Complexes as Crosslinker; Int J Mol Sci. 2022 May 17;23(10):5594. doi: 10.3390/ijms23105594.
Prijašnja istraživanja:
Naša prethodna istraživanja usredotočila su se na složene regulatorne mreže koje kontroliraju stanični ciklus i staničnu smrt u tumorskim stanicama, s ciljem razumijevanja kako antitumorski agensi induciraju staničnu smrt i kako defekti u tim putovima utječu na ishode terapije. Posebna je pozornost bila posvećena genu p53, ključnom regulatoru većine staničnih odgovora povezanih s liječenjem i jednom od najčešće mutiranih gena u ljudskim tumorima, kao i genu p21WAF1/CIP1, koji igra središnju ulogu u starenju, ali ima kontradiktornu funkciju u apoptozi i nedovoljno istraženu ulogu u autofagiji. Istraživali smo i njihovo eventualno korištenje u genskom liječenju.
Također, istražili smo korelaciju između oštećenja molekule DNA izazvanih antitumorskim spojevima i staničnih odgovora, naglašavajući važnost neapoptotičkih mehanizama poput senescencije, mitotičke katastrofe i autofagije, te njihovo međudjelovanje s apoptozom. Poseban fokus istraživanja bio je usmjeren na mehanizme kojima gen p21WAF1/CIP1 regulira različite oblike odgovora tumorske stanice na terapiju/stres te na koji način karakterizira kemoosjetljivost stanice. Pokazali smo da može imati dvojaku ulogu u apoptozi te da njegova pojačana ekspresija može izazvati autofagiju, koja potom omogućava aktivaciju senescencije i/ili apoptoze. (Znanstveno-istraživački projekt, MZOŠ, Hrvatska: „Uloga različitih mehanizama odgovora stanica na terapiju oštećenjem DNA“ 2007-2013).
- Kraljević Pavelić, S; Čačev, T; Kralj, M. A dual role of p21waf1/cip1 gene in apoptosis of HEp-2 treated with cisplatin or methotrexate. Cancer Gene Ther. (2008) 15:576-590.
- Kraljević Pavelić, S#; Marjanović, M#; Poznić, M; Kralj, M. (2009) Adenovirally-mediated p53 overexpression diversely influence the cell cycle of HEp-2 and CAL 27 cell lines upon cisplatin and methotrexate treatment. J Cancer Res Clin Oncol. 135:1747-1761. #First autor – equal conribution
- Mikecin A-M, Walker L, Kuna M, Raucher D. Thermally targeted p21 peptide enhances bortezomib cytotoxicity in androgen-independent prostate cancer cell lines. Anticancer Drugs. (2014) 2: 189–199.